产品注册方案 | 有创型血糖仪
目前我国已成为世界上拥有糖尿病患者人数最多的国家,糖尿病已成继心血管疾病和肿瘤之后的第三大非传染性疾病。
血糖监测作为糖尿病管理的重要内容,其结果可以反应糖尿病患者糖代谢紊乱的程度,从而制定合理的降糖方案、评价降糖治疗效果、指导调整治疗方案等。
今天小编和大家聊聊有创型血糖仪注册在国内注册中需要关注的几个关注点。
1、产品的结构和组成
按其工作原理分为电化学式和光化学式两类产品。一般由检测模块、信号放大模块、AD采集模块、数据处理模块、显示模块、嵌入式软件、信号输出部分(如适用)、电源电路以及按键控制电路等组成。
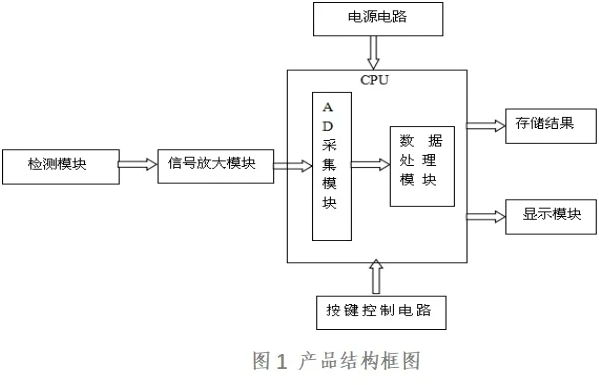

2、工作原理
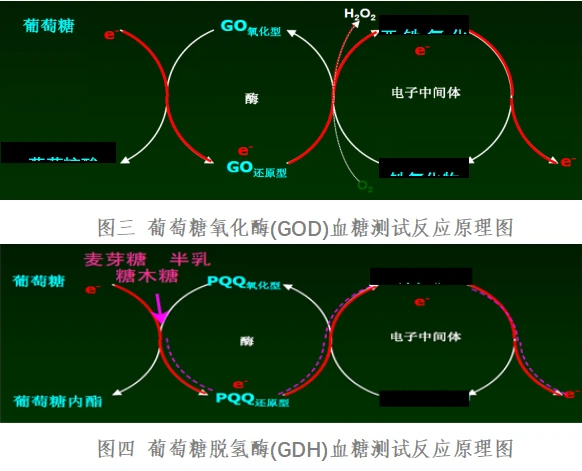
血糖仪按工作原理分为电化学式和光化学式两类产品。
电化学法采用检测酶反应过程中产生的电流信号的原理来反应血糖值,酶与葡萄糖反应产生的电子通过电流记数设施,读取电子的数量,再转化成葡萄糖浓度读数。根据电化学法血糖测试条中所采用的酶不同又分为葡萄糖氧化酶(GOD)法和葡萄糖脱氢酶(GDH)法两种类型。
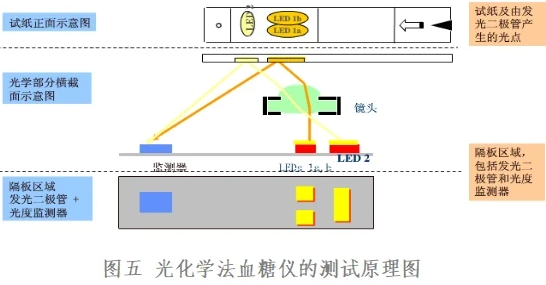
光化学法是检测反应过程中试条的颜色变化来反应血糖值,血糖测试条中所采用的酶一般为葡萄糖氧化酶(GOD),通过酶与葡萄糖的反应产生的中间物(带颜色物质),反应后试纸颜色发生改变,运用检测器检测试纸反射面的吸光度,根据朗伯-比尔定律即可求出血糖浓度。
3、风险管理类别
根据《医疗器械分类目录》,血糖仪的管理类别为Ⅱ类,分类编码为22-02-02,属于02生化分析设备中的02血糖及血糖相关参数分析仪器。

4、产品注册单元划分
01、产品的基本原理不同,应划分为不同的注册单元。(例:利用电化学法为基本原理的血糖仪与利用光化学法为基本原理的血糖仪应划分为不同的注册单元)
02、性能指标有较大差异的,应考虑划分为不同的单元。
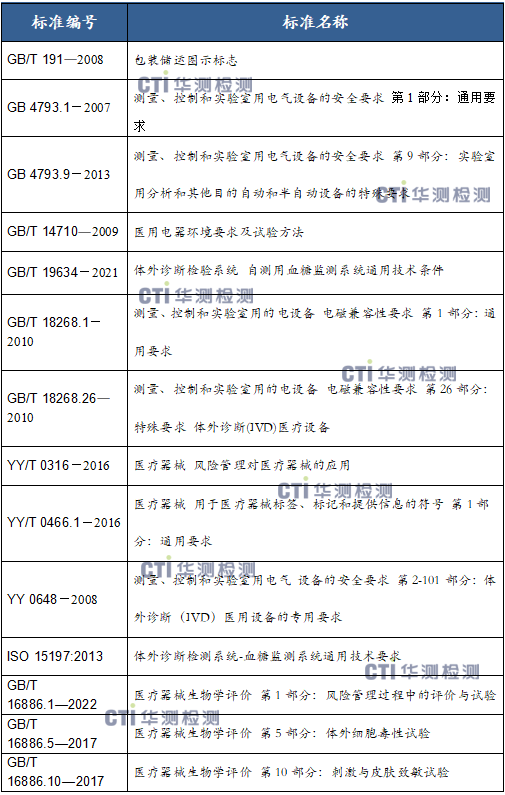
5、产品适用的相关标准
6、临床评价路径
《医疗器械注册与备案管理办法》中第三十四条规定:免于进行临床评价的,可以免于提交临床评价资料。免于进行临床评价的医疗器械目录由国家药品监督管理局制定、调整并公布。
血糖仪被列入在《免于进行临床评价医疗器械目录(2023年)》中,属于免于进行临床评价的医疗器械,可以免于提交临床评价资料。









